Az intermedier anyagcsere – bioenergetika
- 2012. szeptember 11-12.
- Előadó: Bánhegyi Gábor
- az energiafajták egymásba átalakíthatóak, összegük a világegyetemben állandó
- a világegyetem rendezetlensége (entrópia) fokozódik
- az élőlények nyílt, izobár-izoterm rendszert alkotnak, rendezettségüknek fenn kell maradni, ehhez környezetükből vesznek fel energiát.
Energiaforrások:
- primer – Nap energiája – autotróf élőlények hasznosítják kb 0,02%-át fotoszintézis segítségével
- kémiai energia – heterotróf élőlények hasznosítják
A felvett energia átalakítandó, raktározandó.
A táplálék makromolekuláinak (glikogén, lipidek, GAG, fehérjék, stb.) lebontása építőkövekre (monoszacharidok, zsírsavak, aminosavak, koleszterol stb.) = EMÉSZTÉS majd további lebontás: KATABOLIZMUS (főként szervetlen anyagok keletkeznek CO2, H2O, urea, urát, NH3 stb.)
Bioszintézis: ANABOLIZMUS = saját makromolekulák felépítése a táplálékból keletkezett építőkövekből.
katabolizmus + anabolizmus = METABOLIZMUS.
A katabolizmus során energia szabadul fel, ebből a felszabadult energiából fedezi a szervezet az anabolizmus, a mozgás, membrántranszport, jelátvitel energiaigényét és felhasználódik a testhőmérséklet fenntartására is.
- ∆G – szabadenergiaváltozás (rendszer munkavégző képessége állandó hőmérsékleten és nyomáson)
- ∆G° - szabadenergiaváltozás meghatározott körülmények között (standard körülmények)
- ∆G’° - standard szabadenergia-változás – meghatározott állapot + meghatározott pH (0,1 MPa, légköri nyomás, 25 C° , pH=7, 1 M)
ha ∆G’° (−) → exergonikus reakció
ha ∆G’° (+) → endergonikus reakció
Spontán / nem spontán reakciók
No1: A + B → C + D ( ΔG < 0 → exergonikus )
Ha a reakció aktiválási energiája alacsony, előre halad.
Ha a reakció aktiválási energiája magas, katalízis szükségeltetik.
No2: E + F → G + H ( ΔG > 0 → endergonikus )
Ha a reakció aktiválási energiája alacsony, hátrafelé halad.
Ha a reakció aktiválási energiája magas, katalizátor jelenlétében hátrafelé halad.
A katalizátor nem változtatja meg az adott reakció irányát!
Enzimek
- csökkentik az aktiválási energiát
- irányítják a reakciót
- fokozzák a reakció sebességét ( karboanhidráz: 107 )
Kapcsolt reakciók
A spontán reakciók szabadenergiaváltozása részben felhasználható és/vagy más energiává alakítható. Az enzim, ami egy spontán reakciót kapcsolni tud egy nem-spontánnal, vagy mindkét reakciót katalizálja egyidejűleg, vagy egyiket sem.
- közös intermedier az aktív centrumban
- konformációváltozás az enzimfehérjében a spontán reakció után (pl foszforiláció: P csoport → (-) töltés )
- A + B → C + D (ΔG = -50 kJ/mol)
- E + F → G + H (ΔG = +30 kJ/mol)
Ha a reakciók aktiválási energiája alacsony, előre (1) illetve hátrafelé (2) haladnak, nincs lehetőség az összekapcsolásukra. Ha a reakciók aktiválási energiája magas (=katalízis szükséges) a két reakciót egy közös enzim katalizálhatja, és mindkettő előrefelé halad.
Ebben az esetben a kapcsolt reakció: A + B + E + F → C + D + G + H (ΔG = -20 kJ/mol)
pl.: szukcinil-KoA szintetáz (citrátkör)
- R-KoA + H2O → szukcinát + KoA - spontán
- GDP + Pi → GTP + H2O - nem spontán
kapcsolt reakció: R-KoA + GDP + Pi → szukcinát + KoA + GTP (∆G’° = -2,9 kJ/mol) (reverzibilis reakció, de mivel a szukcinát rögtön továbbalakul, egyirányú.)
Kapcsolt reakciók - Csoportátvitel
pl.: piruvát-kináz (glikolízis)
- foszfoenol-piruvát + H2O → piruvát + Pi spontán
- ADP + Pi → ATP + H2O nem spontán
kapcsolt reakció: foszfoenolpiruvát + ADP –> piruvát + ATP (∆G’°=-31,4kJ/mol) (spontán, irreverzibilis reakció)
Ugyanaz a csoport különböző eredetű lehet és sokféle szubsztrátra vihető át. A csoportátvivők csökkentik a szükséges enzimek számát. A csoportátvivők általában koenzimek.
| koenzim | átvitt kémiai csoportok | prekurzor emlősökben |
|---|---|---|
| biotin | CO2 | biotin (B7) |
| koenzim A | acil csoportok | pantoténsav (B5) |
| 5’-Deoxiadenozilkobalamin és metilkobalamin | H atomok és alkik csoportok | B12 vitamin |
| FAD | elektronok | riboflavin (B2) |
| liponsav | elektronok és acil csoportok | - |
| NAD+ | hidrid ion: H- | nikotinsav (niacin/B3) |
| piridoxál foszfát | amino csoportok | piridoxin (B6) |
| tetrahidrofolát | egyszénatomos csoportok | folát (B9) |
| tiamin pirofoszfát | aldehidek | tiamin (B1) |
| purin nukleotidok (ATP/GTP) | foszforil csoport | - |
csoportátviteli potenciál (csáp)
Definíció: A hidrolízis negatív szabadenergia változása. (A csoport eltávolításakor felszabaduló szabadenergia.)
-ΔGhidrolízis (kJ/mol)
Jelentése: A csoportátadás tendenciáját mutatja. A magasabb csoportátviteli potenciállal rendelkező molekula a donor, az alacsonyabbal az akceptor. → A csoportátvitel iránya előre jelezhető.
Használata: A csoportátviteli reakció szabadenergia változása kiszámítható a csoportátviteli potenciálok különbségéből.
Az átvivőknek általában magas (de nem a legmagasabb csáp-ja van.)
Foszforilcsoport-átvitel
- központi szerepet játszik a kapcsolásban
- az ATP a sejt anyagcseréjének „szabadenergia eurója”
Miért jó átvivő az ATP?
miért jó átvivő az ATP:
- a poláros P = O kettős kötés a foszfátokat érzékennyé teszi a nukleofil támadás, így a hidrolízis iránt
- a negatívan töltött (fiziológiás pH-n) foszforil csoportok taszítják egymást
- az eltávolított foszfátot a rezonancia (delokalizáció) stabilizálja
- a hidrolízist savi disszociáció követi fiziológiás pH-n
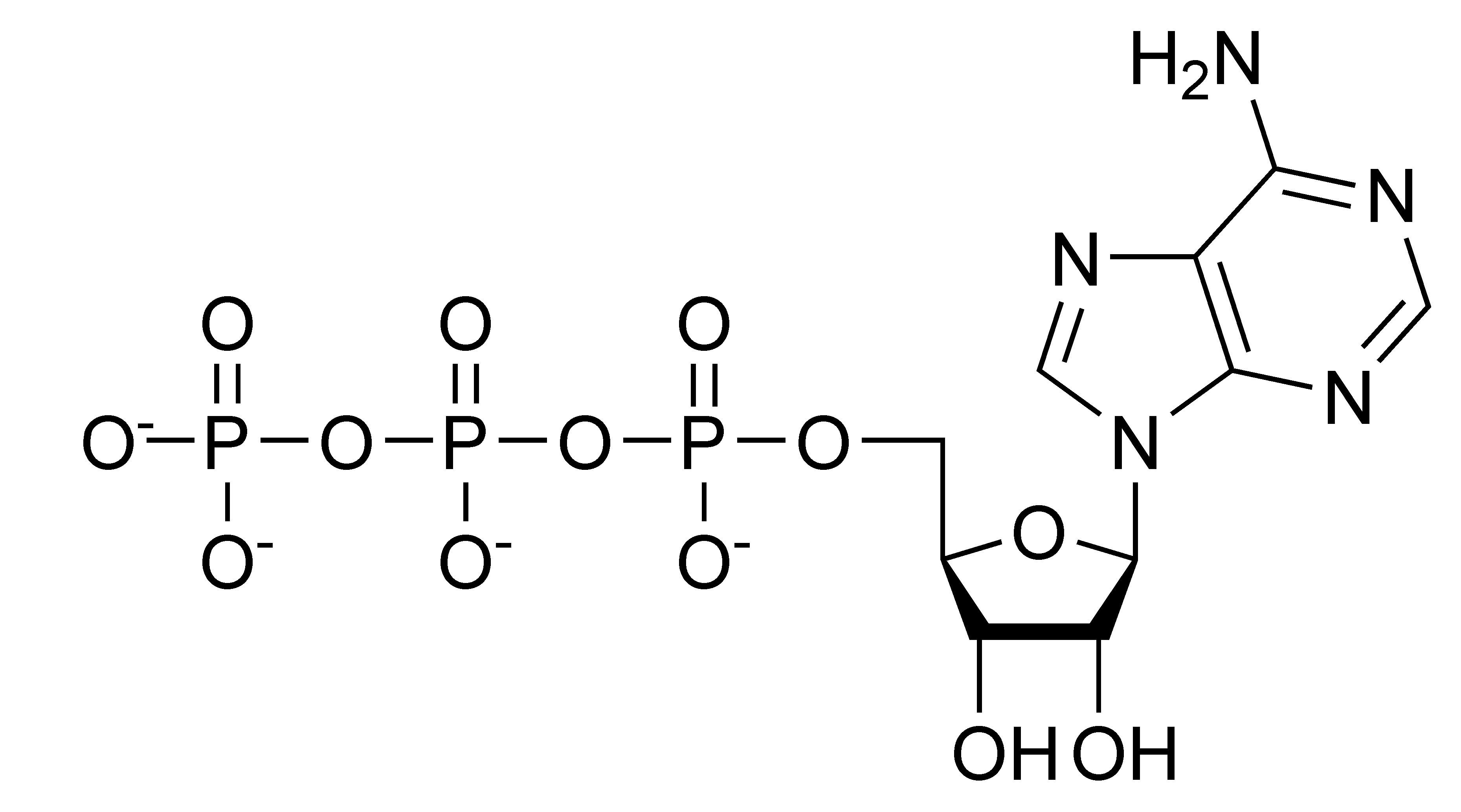
ATP
- a leggyakoribb foszforilcsoport átvivő a sejtben.
- két magas csáp-ú savanhidrid kötésének bontása 30,5 kJ/mol (ATP → ADP) vagy 64,6 kJ/mol (ATP → AMP) szabadenergiát szolgáltathat.
Intracelluláris koncentráció: 2-10 mM Teljes mennyiség emberben: ≈ 50 g. Felhasználás: ≈ 50 kg/nap (nyugalomban) ≈ 0.5 kg/min (sport)
energiatöltés: azt jellemzi, hogy a sejt energetikailag milyen állapotban van. 0 és 1 között változhat. 0, ha minden adenin nukleotid AMP a sejtben. 1, ha csak ATP van a sejtben.
ADP -> ATP
a katabolizmus szabadenergia terhére
- oxidatív foszforiláció
- az ATP termelését a légzési lánc biztosítja (mitok.)
- ATP szintézis spontán iontranszporthoz kapcsolt
- a fő ATP forrás aerob körülmények között
- szubsztrátszintű foszforiláció
- minden más ATP termelő reakció a sejtben
- az ATP szintézis spontán biokémiai reakcióhoz kapcsolt
- az egyedüli ATP forrás anaerob körülmének között (1+2)
- foszfoglicerát kináz (glikolízis)
- piruvát kináz (glikolízis)
- szukcinil-KoA szintetáz (citrát ciklus)
- (kreatin kináz)
ATP -> ADP
- bioszintézis (nem spontán anabolikus reakciók)
- mozgás (izomösszehúzódás + intracell. mozgások)
- transzport
- primer aktív transzport: pumpák (ATP-ázok) - grádiens létrehozása
- másodlagosan aktív transzport: primer pumpa által létrehozott grádiens terhére
- jelátvitel és szabályozás (receptorok, regulátor fehérjék, transzkripciós faktorok és effektor enzimek foszforilációja. cAMP szintézis ATP-ből (adenilát-cikláz)
- egyéb - speciális ATP felhasználó folyamatok
ATP → ADP + Pi (30kJ/mol) ATP → AMP + Pi + Pi (a pirofoszfát is hidrolizál) (68kJ/mol) ATP → AMP + PPi (30kJ/mol)